
資訊 
了解行業(yè)以及華進(jìn)新聞資訊。
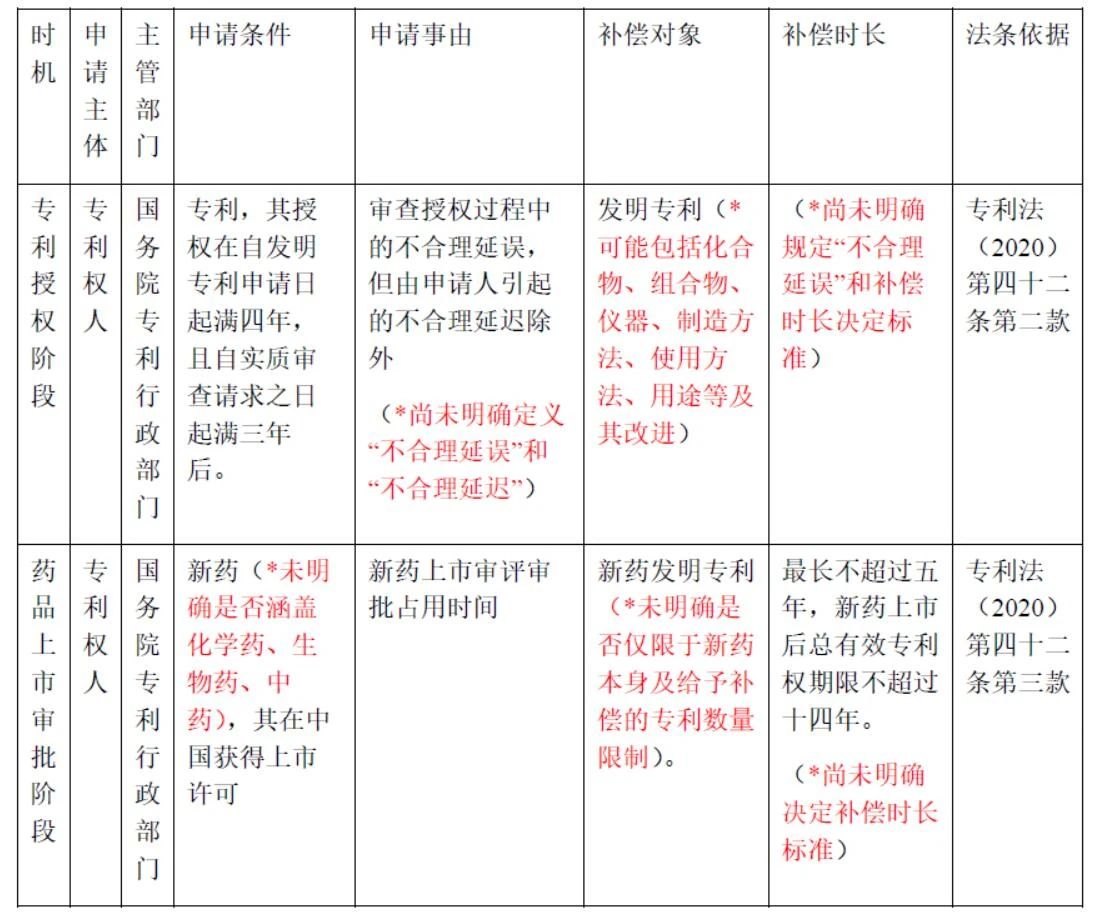
專利法修改解讀 | 藥品專利鏈接制度條款
2020-11-02

 400-883-1990
400-883-1990
 info@aciplaw.com
info@aciplaw.com

華進(jìn)官方微信公眾號(hào)
Copyright ? 2021 華進(jìn)聯(lián)合專利商標(biāo)代理有限公司.All Rights Reserved.粵ICP備12081038號(hào)